La farmacovigilanza nasce ufficialmente nel 1961 in Gran Bretagna in seguito ai gravi eventi avversi causati dalla somministrazione della Talidomide a donne in gravidanza. Numerosi però sono gli eventi che hanno segnato la storia della farmacovigilanza. Ecco la sua evoluzione, dalle radici nel lontano 1848 con l’uso del Cloroformio, alla sua forma attuale.
Cos’è la farmacovigilanza?
Il termine farmacovigilanza deriva dalle parole greche e latine pharmakon, ovvero sostanza medicinale e vigilia, ovvero vegliare. La farmacovigilanza, secondo l’Organizzazione Mondiale della Sanità (OMS), è “la disciplina e l’insieme di attività volte all’individuazione, valutazione e prevenzione di effetti avversi o altri problemi correlati all’utilizzo dei farmaci”. È dunque un’attività fondamentale per garantire il profilo di sicurezza di un farmaco.
Puoi approfondire leggendo l’articolo: Farmacovigilanza: cos’è e a cosa serve
Quando nasce la farmacovigilanza?
La farmacovigilanza nasce nel 1961 in Gran Bretagna, quando, in seguito alla somministrazione di Talidomide alle donne in gravidanza, si manifestarono numerosi episodi di malformazioni fetali. Questo evento cruciale segnò l’avvio dell’attività di sorveglianza sui farmaci, ma numerosi sono stati i casi di reazioni sospette precedenti che hanno condotto a questa attività per come la conosciamo oggi. Il primo avvenne nel 1848.
Storia della farmacovigilanza: eventi chiave
Come precedentemente accennato, nel corso degli anni sono stati diversi gli eventi che hanno condotto alla costituzione della farmacovigilanza moderna. Eccoli di seguito.
1848 – Cloroformio
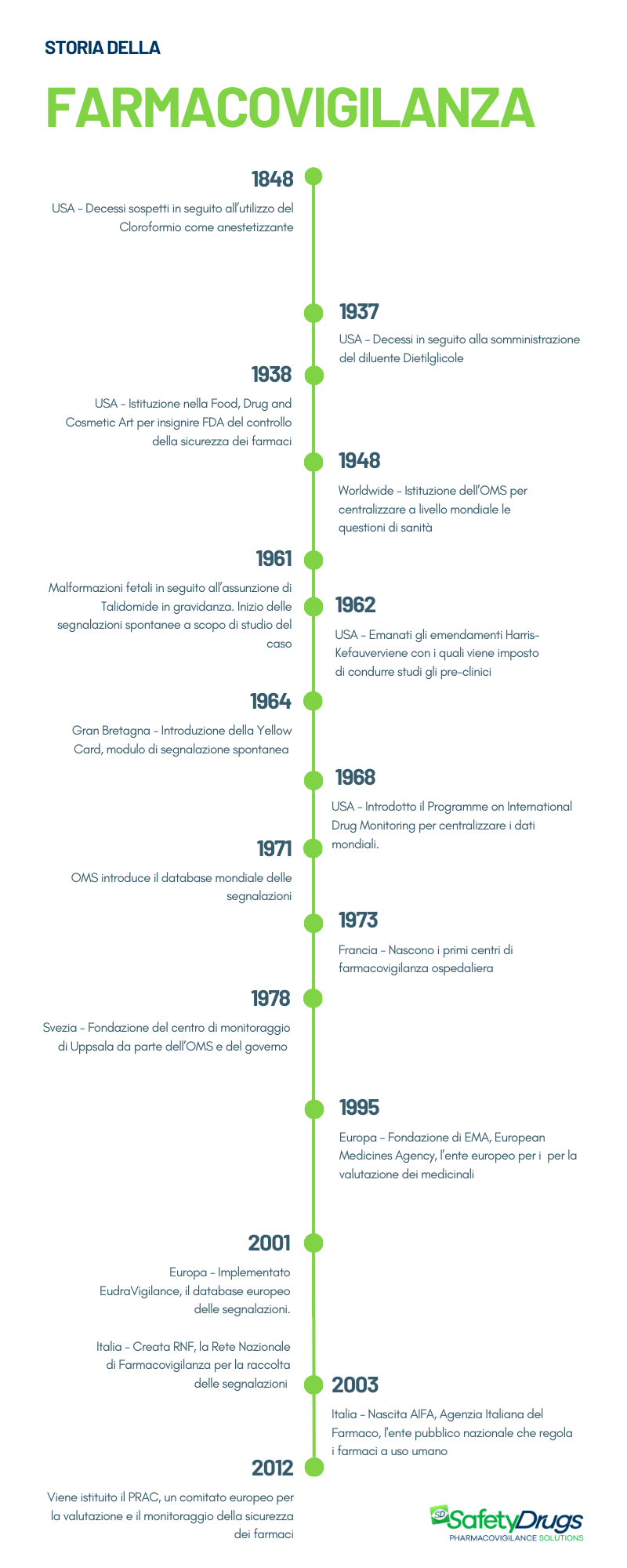
La storia della farmacovigilanza ha origini nel 1848, quando in Gran Bretagna si verificarono una serie di decessi sospetti durante operazioni in cui veniva somministrato ai pazienti il cloroformio come anestetico.
Il cloroformio venne utilizzato come anestetizzante a partire dal 1847. L’anno seguente una ragazza di soli 15 anni morì in seguito alla sua assunzione. Questo tragico evento suscitò preoccupazione spingendo il Lancet Journal a istituire una commissione e a sollecitare i medici inglesi a segnalare casi simili. Si aprì dunque un dibattito sulla sicurezza delle procedure anestetiche e in seguito a varie segnalazioni, il farmaco cessò di essere utilizzato come anestetico nel 1976. Questo episodio rappresentò il primo passo verso l’istituzione di procedure di sicurezza farmacologica.
1937 – Sulfanilamide
Un altro punto di svolta avvenne negli Stati Uniti nel 1937, quando 107 persone, tra cui 76 neonati, persero la vita a causa di una nuova formulazione liquida di Sulfanilamide contenente come diluente il solvente il Dietilglicole, causa delle reazioni fatali. Attualmente, questo componente è noto per la sua elevata tossicità ed è utilizzato come liquido antigelo nei motori delle vetture. Questa tragedia evidenziò l’importanza di garantire la sicurezza non solo del principio attivo, ma anche degli eccipienti che compongono il farmaco.
1961 – Talidomide
L’evento decisivo per la nascita della farmacovigilanza si verificò nel 1961 quando l’uso della Talidomide in gravidanza causò un aumento del 20% di malformazioni congenite nei neonati. Il farmaco venne sperimentato per due anni su 300 pazienti, senza rilevare particolari effetti collaterali. Considerato dunque sicuro venne commercializzato a partire dal 1957 in oltre 50 Paesi. La Talidomide veniva utilizzata soprattutto come sedativo, antiemetico ed ipnotico nelle donne in gravidanza. La sua somministrazione causò una grave anomalia nello sviluppo del feto: i neonati avevano gravi deformità degli arti, soprattutto quelli superiori, come l’assenza (amelia) o la riduzione delle ossa (focomelia). Circa 10.000/20.0000 bambini subirono uno sviluppo incompleto.

Gli effetti della Talidomide: bambini affetti da focomelia – Colonia, Germania, 24 marzo 1968
Nel 1961, segnalazioni su possibili correlazioni tra Talidomide e malformazioni congenite furono pubblicate sulla rivista scientifica Lancet. La svolta avvenne con la lettera del Dottor William Griffith McBride nel dicembre dello stesso anno, in cui suggeriva una connessione tra le malformazioni congenite e l’assunzione del farmaco e rendendo pubblici i primi casi di anormalità fetale legate alla Talidomide. Questa può considerarsi come l’inizio delle segnalazioni spontanee. Si consolidò dunque l’ipotesi della correlazione tra le malformazioni e l’assunzione del farmaco, che venne ritirato dal commercio.

Lettera di McBride al Lancet Journal relativamente agli effetti della Talidomide
Questo evento nella storia della farmacovigilanza segnò il passaggio da attività occasionale a processo sistematico, organizzato e regolamentato.
Storia della farmacovigilanza: nascita degli enti
In seguito a questi eventi, emersero i primi enti e le prime procedure volte alla sorveglianza della sicurezza del farmaco.
Nel 1938 negli Stati Uniti venne istituita la Food, Drug and Cosmetic Act (FFDCA, FDCA, or FD&C), un insieme di leggi per insignire la Food and Drug Administration (FDA) (istituita nel 1906) alla supervisione sulla sicurezza di alimenti, farmaci, dispositivi medici e cosmetici, gettando le basi della legislazione farmaceutica.
Nel 1948 venne fondata l’Organizzazione Mondiale della Sanità (OMS) con sede a Ginevra per centralizzare a livello mondiale le questioni sanitarie.
Nel 1962, successivamente all’incidente legato alla Talidomide, negli Stati Uniti furono introdotti gli emendamenti Harris-Kefauver, i quali prescrissero la necessità di condurre studi preclinici obbligatori. Solo dopo la valutazione dei risultati di tali studi era consentito avviare la fase di sperimentazione clinica sull’uomo. Inoltre, l’autorizzazione alla commercializzazione dipendeva dai dati ottenuti nelle tre fasi della sperimentazione clinica. Dopo la commercializzazione i farmaci erano sottoposti a sorveglianza post-marketing.
Nel Regno Unito, nel 1964, fu introdotta la Yellow Card, il primo modulo di segnalazione di reazioni avverse da parte dei medici.
L’OMS, nel 1968, promosse il Programme on International Drug Monitoring (PIDM), un programma di monitoraggio internazionale dei farmaci volto a centralizzare i dati mondiali sulle reazioni avverse. Vennero inizialmente coinvolti 10 Stati: Australia, Canada, Cecoslovacchia, Irlanda, Paesi Bassi, Germania, Nuova Zelanda, Svezia, Regno Unito, Usa (l’Italia aderì nel 1975). Il programma risultò fin da subito efficace: l’anno seguente emerse che il Cliochinolo, un farmaco anitimicotico, causava neurite ottica retrobulbare nei Paesi asiatici rivelando una suscettibilità etnica ai farmaci e ai loro effetti avversi. Inoltre, nel 1971 emerse che il Dietilstilbestrolo, un estrogeno di origine sintetica, che veniva somministrato a partire dagli anni ’40 a donne incinte per prevenire aborti spontanei e per alleviare le nausee, causava tumori genitali nelle figlie delle donne esposte a tale sostanza durante la gravidanza. Per la farmacovigilanza significava apprendere che gli effetti avversi dei farmaci possono verificarsi a distanza di anni o addirittura nella generazione seguente.
In quello stesso anno, l’OMS creò il database mondiale delle segnalazioni localizzato a Uppsala, in Svezia.
Nel 1973, la Francia inaugurò i primi sei centri di sorveglianza ospedaliera, dove fu formalmente adottato il termine farmacovigilanza.
Il governo svedese e l’OMS nel 1978 fondarono il centro di monitoraggio di Uppsala.
Nel 1995, venne fondata l’Agenzia Europea per i Medicinali (EMA). Nel 2001 fu implementata Eudravigilance la banca dati europea per la gestione delle segnalazioni.
In Italia, nel 2001 venne creata la Rete Nazionale di Farmacovigilanza (RNF) per raccogliere le segnalazioni di reazioni avverse a livello nazionale e nel 2003 nasce l’Agenzia Italiana del Farmaco (AIFA).
A riprova della crescente sensibilizzazione a livello nazionale, vennero istituiti alcuni gruppi collaborativi come il Gruppo Interregionale di Farmacovigilanza (GIF) e il Gruppo Italiano Studi Epidemiologici in Dermatologia (GISED).
Inoltre, dal 2006, le aziende sanitarie italiane sono obbligate a designare una persona qualificata come responsabile dell’attività di farmacovigilanza (QPPV).
Con l’istituzione del Pharmacovigilance Risk Assessment Committee (PRAC), nel 2012, il sistema di farmacovigilanza europeo è stato ulteriormente rafforzato, definendo chiaramente ruoli e responsabilità. Il PRAC è incaricato della valutazione e del monitoraggio della sicurezza dei medicinali per uso umano, fornendo raccomandazioni ai comitati competenti.
Storia della farmacovigilanza: timeline
Storia della farmacovigilanza: lo scenario attuale
La farmacovigilanza ha fatto progressi significativi, passando da un sistema di monitoraggio passivo che si basava esclusivamente sulla segnalazione spontanea di sospette reazioni avverse a un approccio più proattivo. Quest’ultimo si avvale di strumenti e procedure mirati che includono una pianificazione dettagliata del monitoraggio del rischio (Risk Management Plan). Le normative di farmacovigilanza hanno svolto un ruolo chiave nel regolamentare le attività delle varie figure coinvolte e gli aggiornamenti legislativi recenti hanno ampliato la definizione di reazione avversa, includendo errori terapeutici, abusi e sovradosaggi, portando così a un aumento delle segnalazioni. Le normative europee ora richiedono anche maggiore tempestività nelle segnalazioni.
L’evoluzione della farmacovigilanza è stata resa possibile soprattutto grazie al miglioramento sia della quantità che della qualità delle segnalazioni spontanee, coinvolgendo attivamente professionisti e pazienti. Inoltre, sono state condotte attività mirate a perfezionare i metodi di ricerca del segnale e a migliorare la comunicazione con gli operatori sanitari. I sistemi di farmacovigilanza in tutto il mondo stanno subendo cambiamenti significativi in linea con il progresso tecnologico, come il passaggio alle ICH E2B (R3), il recente formato di trasmissione delle schede di segnalazione in formato elettronico – Individual Case Safety Report (ICSR). Un aiuto imprescindibile per tutti gli operatori coinvolti nei processi di farmacovigilanza consiste nel dotarsi di un safety database sviluppato in conformità ai requisiti regolatori più recenti.







