La codifica degli eventi avversi rappresenta un passaggio cruciale nella farmacovigilanza: scegliere il termine corretto significa garantire che i dati siano chiari, confrontabili e utili all’identificazione di segnali di sicurezza. Il MedDRA è il dizionario standard internazionale che rende possibile questo processo. In questo articolo approfondiamo la sua struttura, le logiche gerarchiche e la sua importanza operativa per i professionisti del settore.
Cos’è il MedDRA?
Il MedDRA (Medical Dictionary for Regulatory Activities) è la terminologia medico-regolatoria standardizzata utilizzata a livello internazionale per codificare, classificare e analizzare informazioni relative a eventi avversi, reazioni avverse, condizioni mediche, risultati di esami clinici e malfunzionamenti di dispositivi.
La terminologia MedDRA è stata introdotta negli anni ‘90 da ICH (International Council for Harmonisation) per armonizzare la comunicazione internazionale in ambito medico regolatorio. Fino a quel momento, infatti, il settore si muoveva tra più sistemi terminologici, come WHO-ART© (World Health Organization’s Adverse Reaction Terminology), ICD-9 (International Classification of Diseases Ninth Revision) e COSTART© (Food and Drug Administration’s Coding Symbols for a Thesaurus of Adverse Reaction Terms. Ciò rendeva difficoltoso il recupero, l’incrocio e l’analisi dei dati. L’adozione di MedDRA ha permesso di superare questi limiti, offrendo un linguaggio comune, preciso e aggiornabile. La prima versione, MEDDRA Versione 1.0, fu sviluppata utilizzando come base quella dell’Autorità britannica MCA (ora MHRA – Medicines and Healthcare products Regulatory Agency). La seconda versione, MedDRA Versione 2.0, è stata quella ufficialmente adottata e implementata.
L’ambito di applicazione di MedDRA
La terminologia MedDRA trova applicazione in tutte le fasi del ciclo di vita dei prodotti medicinali per uso umano. In ambito clinico, viene utilizzata per la codifica degli eventi avversi e dei risultati di esami negli studi di fase I, II, III e IV, assicurando uniformità e precisione nella raccolta dei dati. Nel campo della farmacovigilanza post-marketing, MedDRA è lo standard adottato per la codifica delle reazioni avverse segnalate spontaneamente, per la gestione degli Individual Case Safety Reports (ICSR) e per la compilazione dei report periodici di sicurezza (PSUR/PBRER). La terminologia è inoltre obbligatoria nella documentazione regolatoria presentata alle autorità sanitarie (EMA, FDA, PMDA e altre), sia per le richieste di autorizzazione all’immissione in commercio sia per le variazioni e i rinnovi. MedDRA si applica anche nel monitoraggio e nella gestione degli eventi avversi correlati ai dispositivi medici, codificando sia i malfunzionamenti sia le conseguenze cliniche per il paziente. Infine, in alcuni ambiti regolatori specifici, come il monitoraggio di cosmetici o integratori alimentari soggetti a vigilanza, MedDRA può essere utilizzato come linguaggio comune per uniformare la descrizione di eventi e condizioni cliniche rilevanti.
MedDRA copre una vasta gamma di concetti medici e regolatori, tra cui sintomi, malattie, diagnosi, indicazioni terapeutiche, malfunzionamenti di dispositivi medici (ad esempio il termine “Fallimento di dispositivo”) e persino circostanze sociali rilevanti per la valutazione regolatoria (ad esempio i termini “Viaggio all’estero” o “Uso di tabacco”). Questa ampiezza rende MedDRA uno strumento fondamentale per una codifica completa e strutturata dei dati.
MedDRA: la struttura gerarchia
Uno dei punti di forza di MedDRA è la sua struttura gerarchica, progettata per rendere le segnalazioni e le analisi di safety coerenti e facilmente navigabili. Ogni termine può essere esplorato a diversi livelli di specificità, partendo da categorie ampie fino ad arrivare a termini più specifici. La gerarchia è strutturata su cinque livelli: SOC e gruppi SOC, HLGT, HLT, PT e LLT.
SOC e Gruppi SOC (System Organ Class)
I SOC rappresentano il livello più alto della gerarchia MedDRA e raggruppano termini in base a criteri di eziologia, scopo e sede di manifestazione. Un esempio è il SOC “Patologie del sistema nervoso”, che include tutti i termini relativi ai disturbi neurologici.
Alcuni SOC affini sono ulteriormente raccolti in gruppi tematici per consentire analisi più trasversali e complete in aree funzionali connesse. In totale, esistono 27 SOC, ciascuno con un ruolo preciso nella classificazione e nell’analisi dei dati di sicurezza. Ad esempio, le SOC “Patologie renali e urinarie” e “Disturbi del metabolismo e della nutrizione” appartengono allo stesso gruppo funzionale legato alle funzioni metaboliche e renali.
È importante sottolineare che un singolo gruppo SOC può essere collegato a un numero illimitato di HLGT, favorendo così una visione multi-assiale degli eventi avversi.
HLGT (High Level Group Term)
Gli HLGT rappresentano il secondo livello gerarchico di MedDRA e organizzano gruppi di eventi clinicamente correlati all’interno di ciascun SOC. Questi raggruppamenti facilitano il recupero dei dati e consentono un’analisi mirata per area terapeutica o funzione biologica. Ad esempio, all’interno del SOC “Patologie del sistema nervoso” si trova l’HLGT “Patologie neurologiche NCA” (non classificate altrove), che raccoglie i disturbi neurologici che non rientrano in altre categorie specifiche. I termini HLGT svolgono un ruolo chiave nel supportare la presentazione e l’estrazione dei dati.
Ogni HLGT deve essere collegato ad almeno un SOC e ad almeno un HLT. Non esistono limiti al numero di SOC ai quali un HLGT può essere associato, garantendo così una flessibilità che riflette la complessità delle manifestazioni cliniche.
HLT (High Level Term)
Gli HLT costituiscono il terzo livello della gerarchia MedDRA e rappresentano sottogruppi specifici all’interno di ciascun HLGT. Ogni HLT funge da categoria inclusiva che raccoglie i PT (Preferred Terms) collegati da affinità cliniche, anatomiche, fisiologiche, eziologiche o funzionali.
Per esempio, all’interno dell’HLGT “Patologie neurologiche NCA”, possiamo trovare l’HLT “Parestesie e disestesie”, che raggruppa i termini relativi a disturbi della sensibilità, come formicolii, alterazioni e sensazioni anomale. Questo livello di dettaglio consente analisi più precise e un’organizzazione strutturata dei dati.
Ogni HLT deve essere collegato ad almeno un gruppo SOC tramite un HLGT. Inoltre, un HLT può essere associato a un solo HLGT per ciascun SOC, assicurando un percorso gerarchico chiaro e lineare. Tutti gli HLT connessi a un determinato HLGT saranno automaticamente presenti in ogni SOC a cui quell’HLGT è collegato, permettendo così una visione completa dei dati.
PT (Preferred Term)
I PT rappresentano il livello fondamentale per la codifica degli eventi avversi all’interno di MedDRA: sono infatti i termini di codifica principale anche in farmacovigilanza. Descrivono in maniera distinta un evento specifico, come un sintomo, un segno clinico, una malattia, una diagnosi, un’indicazione terapeutica, un’indagine, una procedura medica o chirurgica e una caratteristica di anamnesi famigliare, sociale o medica. Il PT rispetta il principio di equivalenza, ovvero raggruppa sotto un’unica voce termini sinonimi o strettamente correlati, garantendo così coerenza e chiarezza nella codifica e nell’interpretazione. Un esempio di PT è “Sensazione di bruciore”.
Ogni PT deve essere collegato ad almeno un LLT (Lowest Level Term) e può avere un numero illimitato di LLT associati, che ne rappresentano varianti terminologiche, sinonimi o forme abbreviate.
Per evitare duplicazioni durante il recupero dei dati, ogni PT viene assegnato a un SOC primario, pur potendo comparire in più SOC grazie alla multi-assialità. Questo sistema consente di mantenere una struttura coerente e allo stesso tempo flessibile, rispondendo alle diverse prospettive cliniche e regolatorie.
LLT (Lowest Level Term)
I LLT costituiscono il livello più granulare e dettagliato della gerarchia MedDRA. Comprendono sinonimi, quasi sinonimi, varianti lessicali, forme colloquiali o più descrittive del PT associato e termini LLT identici al PT. Un esempio di LLT è “Sensazione di bruciore agli arti”, che permette di codificare la descrizione clinica più specifica riportata nella segnalazione. Questa ampiezza consente di codificare le segnalazioni così come vengono descritte nella pratica clinica, mantenendo allo stesso tempo coerenza e standardizzazione.
Ogni LLT è univocamente collegato a un solo PT e non può essere associato a più termini, garantendo precisione e chiarezza nel processo di codifica.
Qui sotto rappresentiamo un esempio di albero MedDRA per illustrare la gerarchia a livelli. Si tratta di un esempio semplificato e non esaustivo della struttura MedDRA, poiché ogni livello (SOC, HLGT, HLT, PT, LLT) comprende in realtà centinaia o migliaia di termini collegati tra loro secondo criteri clinici, anatomici, fisiologici ed eziologici. Inoltre, grazie alla multi-assialità, ciascun termine può essere associato a più SOC, riflettendo la complessità delle manifestazioni cliniche e la necessità di condurre analisi trasversali e approfondite nei dati di farmacovigilanza.
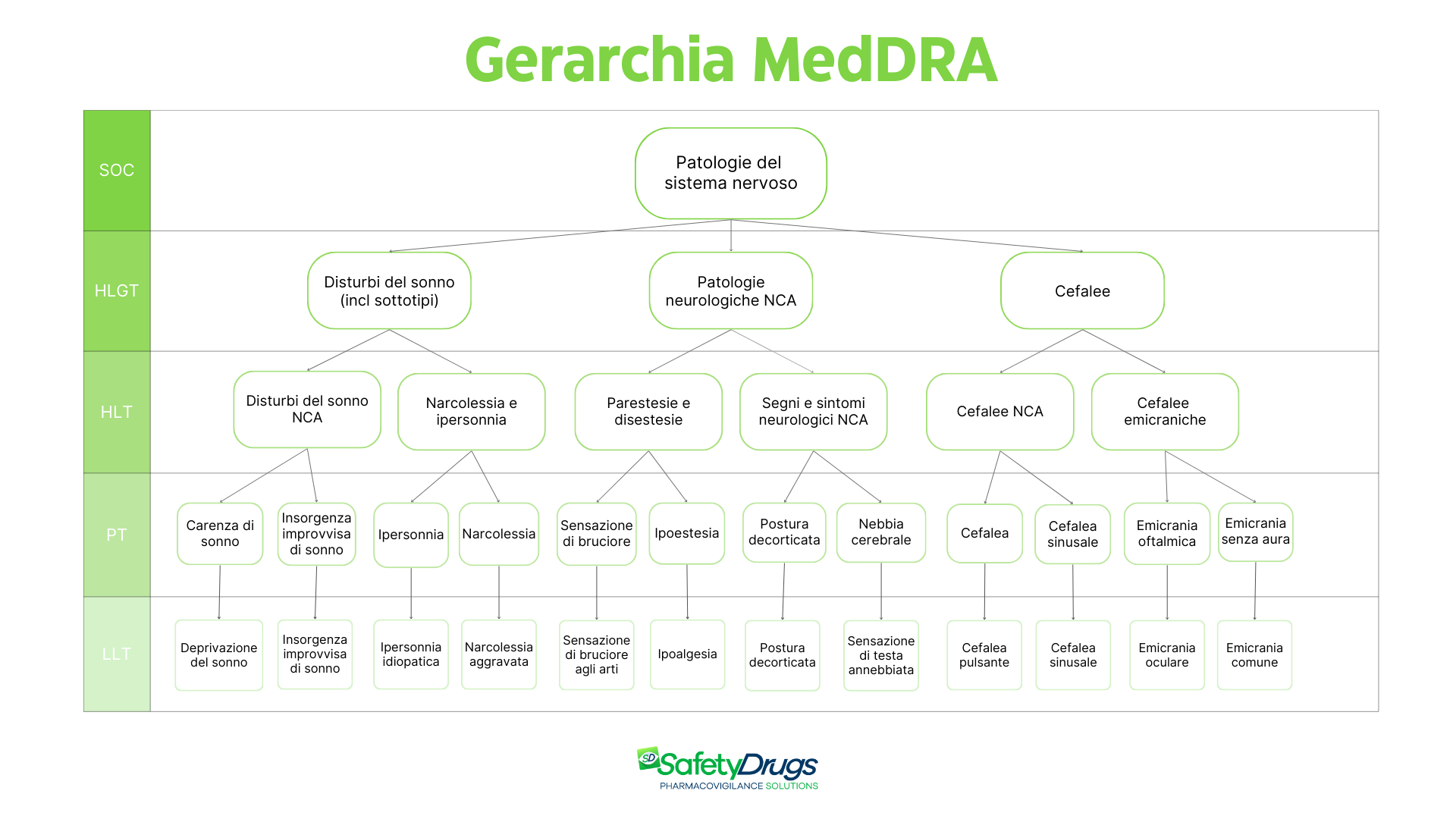
La gerarchia MedDRA rappresentata è un esempio semplificato: ogni livello contiene numerosi altri termini e, grazie alla multi-assialità, un termine può essere associato a più SOC per riflettere la complessità clinica degli eventi. I termini rappresentati si riferiscono alla versione 27.1 del dizionario MedDRA.
Cos’è la multi-assialità di MedDRA e perché è importante
Come sopra citato, il dizionario MedDRA è caratterizzato da multi-assialità. Questa peculiarità consiste nella possibilità che un singolo termine appartenga a più SOC, riflettendo la complessità della clinica. Molti eventi, infatti, non appartengono a una sola SOC, perché le manifestazioni cliniche coinvolgono più apparati.
Per illustrare il concetto di multi-assialità, riportiamo qui sotto un esempio pratico.
Il termine “Edema polmonare del neonato” appartiene a più (SOC): “Patologie respiratorie, toraciche e mediastiniche”, “Condizioni di gravidanza, puerperio e perinatali” e “Patologie cardiache”. Questa caratteristica permette di analizzare lo stesso evento da prospettive differenti, migliorando la capacità di rilevare e interpretare i segnali di sicurezza.
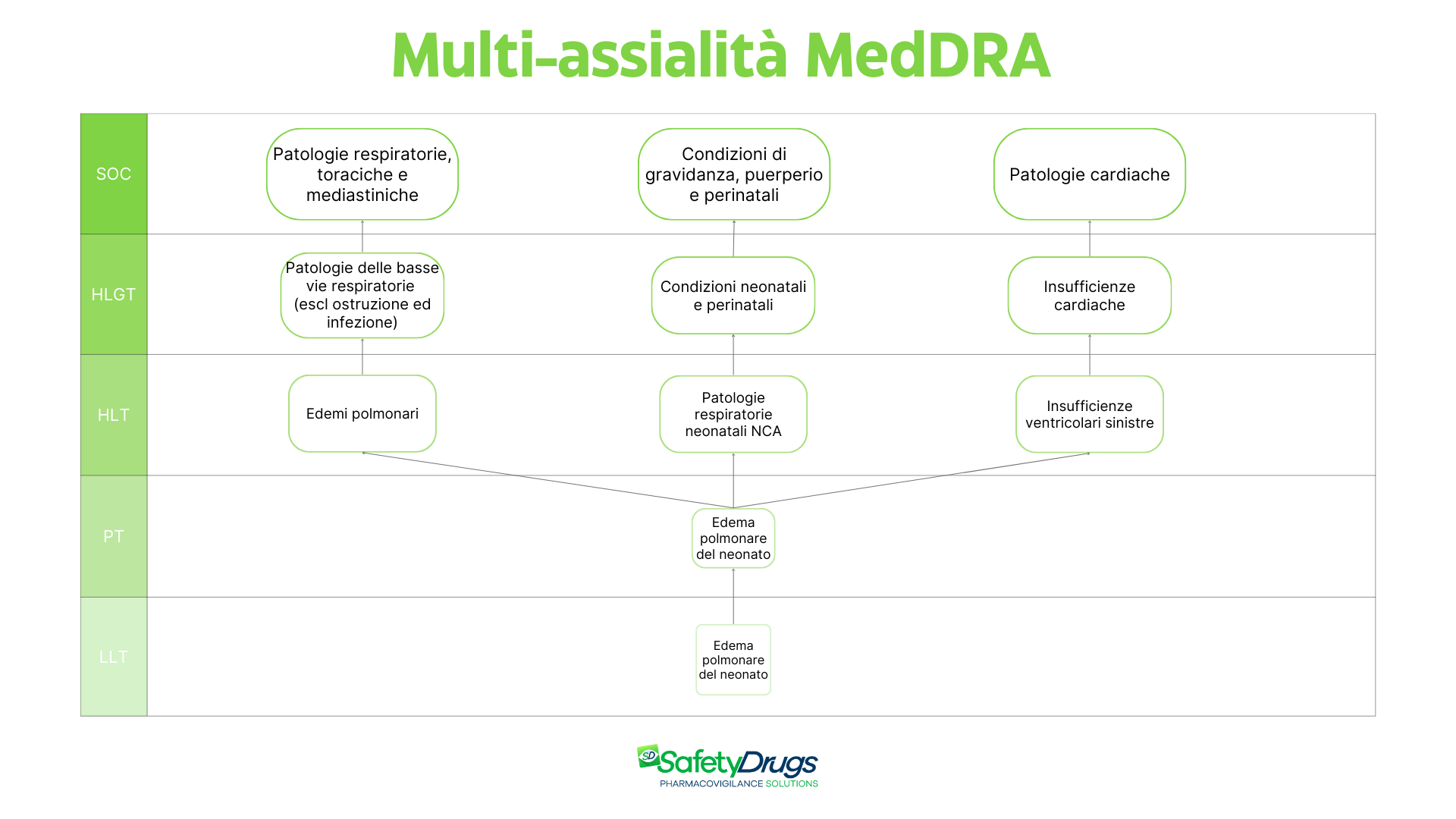
Esempio di multi-assialità: il termine “Edema polmonare del neonato” appartiene a tre diversi SOC, evidenziando la complessità e la flessibilità della struttura MedDRA. I termini rappresentati si riferiscono alla versione 27.1 del dizionario MedDRA.
Codici MedDRA
Ogni termine MedDRA è identificato da un codice numerico univoco composto da otto cifre. Questi codici non hanno alcun significato intrinseco, ovvero, non contengono informazioni sul termine stesso ma servono esclusivamente come identificatori per garantire precisione, tracciabilità e stabilità nel tempo.
I codici furono inizialmente assegnati in ordine alfabetico, a partire dal numero 10000001. Con l’introduzione di nuovi termini nel sistema, i codici vengono attribuiti seguendo una progressione numerica sequenziale. In linea generale, i codici non vengono riutilizzati, a meno che non si tratti di correzioni minori, come modifiche ortografiche o aggiornamenti formali di denominazione. In questi casi specifici, il codice può essere mantenuto per assicurare continuità e coerenza nei database di farmacovigilanza.
SMQ (Standardised MedDRA Queries)
Gli SMQ (Standardised MedDRA Queries) sono insiemi strutturati di termini MedDRA, generalmente selezionati a livello di Preferred Term (PT), che rappresentano specifiche condizioni mediche o aree di interesse clinico. Questi raggruppamenti sono progettati per facilitare la ricerca, l’identificazione e il recupero di casi potenzialmente rilevanti all’interno dei database di farmacovigilanza.
Gli SMQ consentono un’analisi più efficiente e mirata, supportando attività di rilevazione dei segnali di sicurezza e revisione dei dati regolatori. Sono strumenti fondamentali per standardizzare l’approccio nell’individuazione di eventi critici, permettendo un monitoraggio più preciso e una gestione dei rischi più tempestiva.
Gli aggiornamenti MedDRA: un ciclo continuo di miglioramento
Il Maintenance and Support Services Organization (MSSO) rilascia una nuova versione di MedDRA due volte all’anno, a marzo e a settembre. Inizialmente vengono rese pubbliche le nuove versioni in lingua inglese, mentre un paio di settimane dopo vengono pubblicate le versioni in lingue specifiche, tra cui quella in italiano.
Questi aggiornamenti consentono di integrare nuove patologie o eventi emergenti, correggere o affinare termini esistenti e rivedere le relazioni multi-assiali per allinearsi con nuove evidenze.
Gli aggiornamenti possono avvenire anche in casi straordinari, ne è stato un esempio la pandemia da Covid-19 che ha portato il Comitato ad aggiungere tempestivamente nuovi termini nella versione 23.0.
Potrebbe interessarti anche: Aggiornamento MedDRA urgente per includere i nuovi codici da Covid-19
Perché MedDRA è fondamentale nella farmacovigilanza
L’uso di MedDRA non è solo una formalità regolatoria: è una vera e propria leva di qualità e strategia nella gestione dei dati di farmacovigilanza.
Un buon utilizzo di MedDRA consente di:
- rendere le segnalazioni più chiare e analizzabili, evitando errori di interpretazione;
- facilitare la rilevazione dei segnali di sicurezza, grazie alla struttura gerarchica e multi-assiale;
- garantire la confrontabilità dei dati tra mercati diversi, superando le barriere linguistiche;
- integrarsi perfettamente con i sistemi di farmacovigilanza (es. EudraVigilance e FAERS).
MedDRA il compito delle aziende che si occupano di farmacovigilanza
Per le aziende che si occupano di farmacovigilanza restare allineati agli aggiornamenti MedDRA è un requisito imprescindibile. È necessario:
- Scaricare i file aggiornati dal portale MedDRA (occorre avere una licenza).
- Caricarli nei propri sistemi di farmacovigilanza.
- Verificare l’allineamento dei dati pregressi.
Utilizzare una versione obsoleta può causare errori nei report regolatori, incongruenze nei dati e ostacolare le analisi di safety. Ogni errore di codifica può generare un segnale mancato o, al contrario, un allarme immotivato.
MedDRA e qualità delle segnalazioni: il nostro supporto
Gestire ogni aggiornamento può essere complesso. Per questo, offriamo un servizio gratuito di caricamento della nuova release di MedDRA all’interno del safety database nella data ufficiale prevista. In questo modo, i team di farmacovigilanza possono concentrarsi sull’interpretazione clinica dei casi, certi di lavorare sempre con una base dati aggiornata e conforme.
L’utilizzo consapevole di MedDRA, aggiornato e integrato nei processi aziendali, non è soltanto un obbligo normativo, ma un fattore critico per la qualità, la tempestività e la credibilità delle attività di farmacovigilanza.







